混合氢氧气燃烧、氢氧混合燃烧、氢气+空气燃烧的能量区别
机理 | 氢氧混合物为什么会燃烧?(一)
引入
从热力学角度分析,与甲烷(methane)、乙烯(ethylene)、丙烷(propane)、苯(benzene)相比,氢气(hydrogen)具有更高的*热火焰温度(在通常状况下可达2400 K),具有较好的燃烧特性。而且,氢气在氧气中的燃烧产物是水,基本没有环境污染问题。鉴于氢氧混合物燃烧的种种特点,长征五号已经采用了氢氧发动机。此外,氢元素是化石燃料的重要组成部分,任何含氢燃料的燃烧都会和氢氧混合物的燃烧相关,即氢气燃烧机理是含氢燃料燃烧的子机理,会在一定程度上影响反应速率。
本篇推送从化学反应动力学角度出发,分析氢氧混合物爆炸*限。这里的爆炸*限,是指可燃物质与空气混合形成的预混气发生爆炸时,对可燃物质和空气浓度范围以及压强、温度要求。
请在阅读此文之前思考以下问题:
一团和和气气、安安静静的氢氧混合物,温度越高越容易点火爆炸吗? 一团和和气气、安安静静的氢氧混合物,压强越高越容易点火爆炸吗?
图表
下文叙述的主要目的是讲明白氢氧混合物的 z 形压强-温度爆炸*限,这里先给出结果,如图1所示。对于按化学计量数混合的氢氧混合物,即氢气和氧气的摩尔浓度之比为 2 : 1,若其处于 z 形曲线左侧所示的压强-温度状态,就不会发生爆炸;一旦混合物被调整压强或加热而处于 z 形曲线右侧所示的压强-温度状态,就会发生爆炸。表1中列出了氢气和氧气发生化学反应时涉及的重要基元反应,下面的分析就是建立在这些基元反应的基础上的。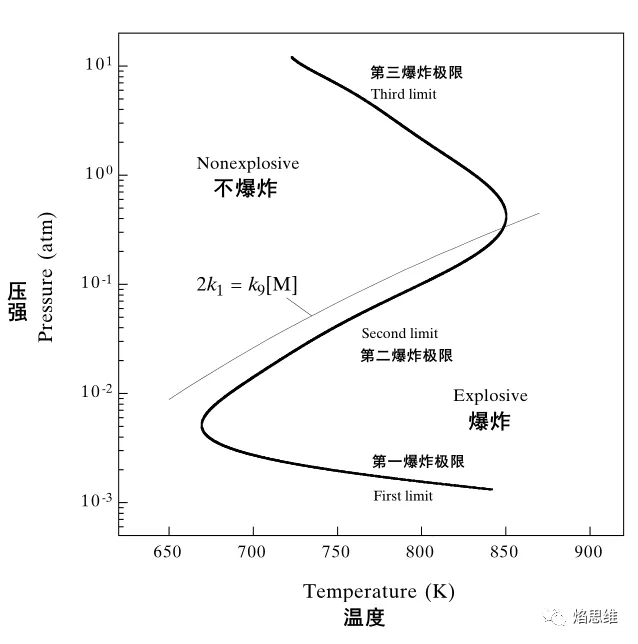 图1. 按化学计量数混合的氢氧混合物的爆炸*限
图1. 按化学计量数混合的氢氧混合物的爆炸*限
表1. 氢气-氧气反应机理
| 编号 | 基元反应 |
|---|---|
| 的链式反应 | |
| 的分解反应和化合反应 | |
| 的生成和分解 | |
| 的生成和分解 | |
注: 表示该反应涉及的其它物质,可能是带来能量或者带走能量的分子、原子、自由基,也可能是包围反应体系的固体壁面,甚*是一束激光等。
链式反应
和的某些基元反应经组合可以看作链式反应,且属于支链反应。本节从链式反应的角度出发,分析和反应的引发和维持。
链引发反应
链引发反应指反应物分子借助光、热等外部因素生成自由基的反应。在该反应过程中,反应物分子的部分化学键断裂,因而其化学反应活化能与相应化学键断裂需要的能量在同一个数量级。
和混合物的引燃只能涉及反应物,因此,下列3个反应是和混合物可能的引发反应,分别为的分解反应、的分解反应以及与的反应。
上述三个反应均为吸热反应,反应热分别为-104、-118、-55 ,而链引发反应的活化能基本等于反应热。这样,反应活化能**,*容易发生,是*重要的链引发反应;反应和在高温条件下才变得明显,且反应更易发生。
链增长反应
链增长反应指支链反应中的原子、自由基等活性基团与反应物分子发生反应而不断生成新的、更多的自由基。若链增长反应不受阻,反应就能一直进行下去,直*反应物消耗殆尽。由于原子、自由基等活性基团具有较强的反应能力,故所需活化能一般较低。对于燃烧反应来说,链增长反应还是主要的放热反应。若经过一系列反应,自由基的数量没有发生变化,则称为链传递反应。
反应和反应产生了原子,原子可以引发下列链式反应:
可以看出,只需1个原子即可引起这三个反应,而在这三个反应完成之后,又生成了2个新的原子,原子的数量随反应的发生而不断增加,进而引起更多的反应。这就说明上述三个反应是链增长反应。
需要注意的是,反应、和为可逆反应。反应和的逆反应是两个自由基间的反应;而在反应开始的阶段,自由基浓度很低,两个自由基间的反应不易发生,故可以忽略这两个逆反应。反应的逆反应是自由基与产物的反应;而在反应开始的阶段,产物浓度很低,故该逆反应也可以忽略。
爆炸*限
首先,在温度较低的前提条件下讨论**、第二、第三爆炸*限;之后,讨论温度较高时的情况。
**爆炸*限
当温度、压力足够低时,爆炸不会发生。这是因为支链反应中的为吸热反应,反应热约为17 ,在温度足够低时不易维持。此外,当压力足够低时,自由基浓度很低而不易碰撞反应,且自由基间很快扩散*包围体系的壁面,并于壁面碰撞而销毁。
当压力升高*一临界值后,自由基在与壁面碰撞销毁之前,有足够的机会与其它分子相遇并发生反应。当温度升高*一临界值后,能够维持吸热反应的持续发生。因此,当温度、压力升高*临界值后,链分支反应加速并超过自由基与壁面碰撞销毁的速率。这样形成的温度、压力临界值就称作**爆炸*限。
第二爆炸*限
在**爆炸*限的基础上继续升高压力,反应
与反应竞争。由于反应涉及到三个反应物分子,压力的升高更显著得提高了其反应速率,*终取代反应而成为反应与反应的主反应。然而,反应的产物的反应活性较低,不易与其它自由基发生反应,*终扩散*壁面而碰撞销毁。这样,反应就成为了链终止反应,链式反应难以继续维持。从爆炸*限的角度看,显著的反应使和的反应难以维持,故成为第二爆炸*限。需要注意的是,在第二爆炸*限附近降低压力才会发生爆炸,而升高压力不会发生爆炸,这与**爆炸*限是不同的。
第三爆炸*限
在由于显著的反应而形成的不爆炸的区域,不断升高压力,反应的产物积累而浓度升高,反应和顺次发生:
反应活性较低的被消耗,生成了活泼的自由基。自由基会继续引发链增长反应、和,这样便达到了第三爆炸*限。
当温度较高时
当温度较高(高于900 K)时,各反应均有较高的反应速率,体系中存在更多的自由基,自由基间的反应变得比低温时显著。
当压力升高*反应足够显著而积累较多的时,有两条反应途径:
一是:
反应需要2个自由基,即需要反应发生2次,消耗2个自由基;该路径*终生成了3个自由基,导致了自由基的积累。该路径可以看作链增长反应,反应并不会导致链终止。
二是:
反应需要1个自由基,即需要反应发生1次,消耗1个自由基;反应同时需要1个自由基,*终生成了2个自由基。因此,经由路径,自由基的数量没有发生变化,可以看作链传递反应。
反应同样需要1个自由基,即需要反应发生1次,消耗1个自由基;反应同时需要1个自由基,*终生成了1个自由基和1个分子。因此,经由路径,自由基的数量减少,可以看作链终止反应。此外,反应和的活化能相当,但反应的指前因子要低一个数量级,这样,反应在于反应的竞争中处于劣势,链终止的表现较弱。
总结
本篇推送从化学反应动力学角度定性分析了氢气-氧气混合体系的**、第二、第三爆炸*限。氢气-氧气混合体系的 z 形爆炸*限揭示了燃烧化学反应动力学的非线性、非单调性和复杂性。
本篇推送尚未就第二爆炸*限进行定量分析,预计这是下一篇推送的内容。
参考文献
[1] LAW C K. Combustion physics [M]. Cambridge University Press, 2006.
[2] LAW C K. Toward Accommodating Realistic Fuel Chemistry In Large-scale Computations [J]. Progress in Energy & Combustion Science, 2009, 35(2): 192-215.
应、能量倍增,